Генераторы кислорода КЦА-типа и мембранного типа.
Компания ООО «КБ «Газспецкомпрессор» производит и работает над усовершенствованием своей продукции, уделяя внимание требованиям наших заказчиков. Наши генераторы кислорода именно поэтому отличаются совершенством.
С нами сотрудничают заводы разных стран, им и поставляем мы генераторы кислорода, азота и другое оборудование.
Работа генераторов кислорода КЦА-типа и мембранного типа.
В генераторах кислорода имеются две колонны с молекулярным ситом, и они функционируют в одно время, обеспечивая бесперебойную работу генератора.
В азотный генератор воздух под давлением поступает через клапан, предварительно очистившись. Молекулярное сито первой колонны не пропускает молекулы других газов, кроме кислорода. Молекулы кислорода попадают в накопительный бак. В следующей колонне регенерируется молекулярное сито, что требует произведенного кислорода. Углеродное молекулярное сито (типовое) возможно использовать примерно 60000 часов.
Специализированный контроллер помогает выполнению производственных процедур с очень большой точностью. Оператор в то же время задает параметры: чистота кислорода, мониторинг процессов, коррекция параметров и сбережения ресурсов во время работы системы.
Кислородный генератор состоит:
1. из системы по производству сжатого воздуха (компрессор воздуха, воздушный ресивер, система фильтрации и осушитель).
2. из кислородного генератора адсорбционного типа и кислородного ресивера.
3. возможно установить систему заполнения и закачки кислорода.
Адсорбенты для получения кислорода методом короткоцикловой безнагревной адсорбции
Адсорбционное разделение воздуха и пути совершенствования процесса
- Способы разделения воздуха…………………………………………………………….
Модифицирование монтмориллонита…………………………………………..
Характеристики адсорбентов и методики экспериментальных исследований……………………………………………………………………………………………
- Характеристики адсорбентов……………………………………………………………..
- Цеолиты типов BEA, ZSM-5, ZSM-12, ЦВМ…………………………..
- Мезопористый силикатный материал МСМ-41…………………
- Монтмориллонитовая глина…………………………………………………….
- Углеродные адсорбенты…………………………………………………………….
- Аэрогели на основе альгинатов и диоксида кремния……….
- Газы………………………………………………………………………………………………..
- Методики проведения экспериментов…………………………………
Активация цеолитов типа X для адсорбционного разделения воздуха 69
- Оптимизация условий активации цеолитов с использованием функциижелательности Харрингтона……………………………………………………………………………….
Глава 4. Выбор пористого наноматериала, селективного к адсорбции аргона из его смеси с кислородом…………………………………………………………………………………..
- Предварительный поиск адсорбента, селективного к аргону…………………
и последующим восстановлением ультразвуком.
Первичный выбор адсорбента для второй ступени установки PSA разделения воздуха с получением чистого кислорода.
Математическая обработка результатов.
Уровни факторов для оптимальных значений критериев оптимизации.
В адсорбционных методах очистки и разделения газов используются пористые наноматериалы различной природы: углеродные адсорбенты, пористые кремнеземы и оксиды алюминия, природные и синтетические цеолиты и др. Возможности контролируемого синтеза и модифицирования наноструктур позволяют получить материалы для селективного извлечения из газового потока целевого компонента и выделения его в концентрированном виде.
Принцип действия адсорбционных воздухоразделительных установок основан на селективном поглощении компонентов воздуха молекулярно- ситовыми адсорбентами (цеолитами или углеродными молекулярными ситами) в условиях короткоцикловой безнагревной адсорбции (КБА). Адсорбционный метод разделения воздуха на цеолитах, используемый в промышленности, не позволяет получить кислород с концентрацией более 95,7 об. % (4,3 об. % приходится на аргон).
Один из путей повышения эффективности работы кислородных генераторов – это определение оптимальных условий предварительной подготовки цеолитов (активации) перед загрузкой в адсорберы установок разделения воздуха. Эта процедура является очень важной операцией, обеспечивающей высокую степень разделения. Целью активации является приведение цеолита в состояние, при котором он проявляет достаточно высокую активность по азоту и минимальную активность по кислороду.
Однако в ряде технологических процессов, таких как лазерная резка конструкционных и низколегированных сталей, требования к чистоте кислорода возрастают. Кислород с концентрацией ниже 99,5 об. % не позволяет получать качественный рез без дефектов. Наиболее целесообразно и экономически оправдано применение при машинной кислородной резке концентрации кислорода не менее 99,2 об. %. Кроме того, с помощью кислорода высокой
чистоты возможно сваривать более тугоплавкие металлы, поскольку он создает повышенную температуру пламени.
Кислород высокой чистоты требуется для решения большого количества различных задач в медицине, фармацевтической промышленности, горнодобывающей промышленности и других отраслях.
Поскольку аргона в кислородообогащенном потоке всего 5 об. %, то для удаления этой примеси (и выделения аргона в концентрированном виде) актуальным является поиск высокоактивных в отношении аргона пористых наноструктурированных материалов, эффективных в разделении кислорода и аргона. Создание адсорбента, способного селективно сорбировать аргон из аргоно-кислородной смеси для получения кислорода с концентрацией 99 об. % и более, значительно увеличит возможности применения адсорбционных генераторов кислорода.
В перспективе создание и применение адсорбента, селективного к аргону, и, как следствие, другим благородным газам, позволит существенно улучшить показатели установок очистки технологических газов АЭС, которые предназначены для удаления радионуклидов благородных газов из газовых смесей, в основном криптона и ксенона, а также разделению благородных газов и азота.
Цель наших разработак на данный момент — определение оптимальных условий предварительной подготовки цеолитов (активации перед загрузкой в адсорберы) для увеличения их адсорбционной способности по азоту.
Разработка адсорбентов на основе пористых наноструктурированных материалов различной природы с повышенной селективностью к аргону для адсорбционного извлечения аргона из его смеси с кислородом и получения кислорода чистотой 99 % и более.
Для достижения поставленных целей были сформулированы следующие
задачи:
- проведение оптимизации условий предварительной активации цеолитов типа Х
для селективной сорбции азота;
- синтез и модифицирование микропористых адсорбентов для получения материалов с повышенной селективностью к аргону для разделения смеси аргон- кислород;
- отбор перспективных адсорбентов, селективных к аргону, для применения в кислородных генераторах и выдача рекомендаций для разработки технологии их получения.
Научная новизна разработок сформулирована в виде следующих положений:
- Присутствие диоксида углерода в продувочном газе (азоте) в процессе предварительной активации цеолитов типа X различного катионного состава приводит к увеличению их адсорбционной емкости по азоту. Методом ИК-спектрометрии показано, что при содержании CO2 в азоте в количестве 2 об. % в больших полостях цеолита X образуются бикарбонатные структуры, препятствующие миграции катионов (центров сорбции молекул азота) в недоступные для адсорбции малые полости и призмы.
- Интеркалированием природной монтмориллонитовой глины металлами III-IV групп Периодической системы синтезирован адсорбент Al-PILC с повышенной селективностью к аргону в системе аргон-кислород. Показано, что удаление катионов кальция и частично натрия из межпакетного пространства монтмориллонита при его модифицировании приводит к возрастанию адсорбции аргона по сравнению с кислородом.
- Выявлено, что модифицирование цеолитов типов Y и ZSM-5 наночастицами (НЧ) серебра и кобальта приводит к увеличению коэффициента разделения смеси аргон-кислород за счет экранирования активных центров сорбции молекул О2.
- Установлено, что аэрогель на основе альгината кальция, модифицированный многослойными углеродными нанотрубками (МУНТ), обладает селективностью к аргону. Повышение сорбционных свойств аэрогеля к аргону, по-видимому,
связано с частичным экранированием углеродом ионогенных групп поверхности аэрогеля.
Значимость. Технология подготовки цеолитов типа X для разделения воздуха методом КБА с получением кислорода, заключающаяся в предварительной термической обработке цеолитов в азоте, содержащем 2 об. % диоксида углерода.
Разработана методика получения цеолитов, модифицированных наночастицами переходных металлов, обладающих повышенной селективностью в отношении аргона для его выделения из смеси с кислородом.
Для практического использования, с целью получения кислорода с чистотой не менее 99 %, рекомендованы цеолиты с высоким содержанием кремния (типов Y и ZSM-5), модифицированные наночастицами серебра.
Разработана методика первичного отбора адсорбентов для второй ступени установки КБА разделения воздуха с получением кислорода чистотой не менее 99 %. Показано, что лучшим адсорбентом для второй ступени установки КБА, предназначенной для выделения аргона из его смеси с кислородом, является цеолит NaY, модифицированный НЧ серебра (образец Ag/NaY(УЗ/ИПС).
Адсорбционное разделение воздуха и пути совершенствования процесса
В промышленности существует три основных способа получения кислорода из воздуха: низкотемпературная ректификация, адсорбционное и мембранное разделение воздуха. Применение того или иного способа во многом определяется производительностью установок и требуемой чистотой получаемого кислорода. На рисунке 1 показана экономическая целесообразность различных способов производства кислорода и его доставки потребителю.
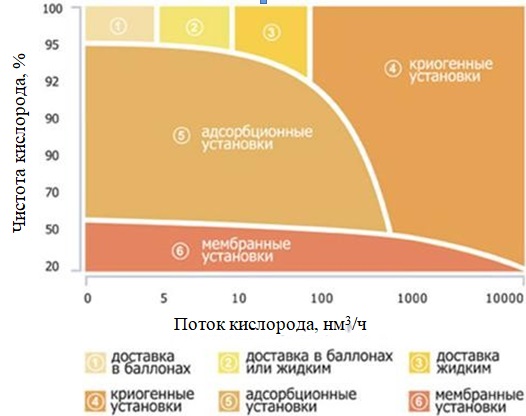
Рисунок 1. Экономическая целесообразность различных способов получения кислорода
Метод низкотемпературной ректификации воздуха основан на разности температур кипения компонентов воздуха и позволяет осуществлять многотоннажное производство чистых продуктов: кислорода, азота, аргона и др. [2; 3]. Установки данного типа обладают целым рядом преимуществ: получение продуктов с низким содержанием примесей (концентрации О2 – 99,9 % об),
надежность оборудования, получение одновременно нескольких продуктов разделения в газообразном и в жидком виде, при этом затраты энергии на 1 м3 кислорода составляют ~ 0,3 кВт/ч и менее.
Однако ввиду сложности аппаратурного исполнения, длительного пускового периода и потребности в специально обученном персонале, применение установок низкотемпературного разделения рентабельны только в случае крупных производств, производительность установок у которых может составлять до 70000 м3/ч.
Значительное развитие в последнее время получил способ разделения воздуха с помощью полупроницаемых мембран, основанный на селективной проницаемости мембран различными компонентами воздуха [4-8]. К основным достоинствам метода можно отнести малые габариты установок, простоту конструкции, быстрый пуск и остановку, экономическую эффективность [9]. Основными же недостатками являются ограниченная производительность и низкая чистота кислорода, возможность получения продукта только в газообразном виде.
При одноступенчатом обогащении воздуха на полимерных мембранах до содержания кислорода 30-40 об. %, удельный расход электроэнергии составляет 0,4-0,6 кВт·ч/м3 [10], а в ряде вариантов — 0,07-0,14 кВт·ч/м3 [11]. Экономическая оценка показывает, что применение мембранных установок целесообразно при производительности по воздуху 500-1500 нм3/ч [8].
Наиболее перспективным с точки зрения создания достаточно крупных автономных промышленных установок разделения воздуха является адсорбционный метод с безнагревной регенерацией адсорбента – короткоцикловая безнагревная адсорбция (КБА, PSA). Применение КБА экономически целесообразно при производительности установок по кислороду от 15 до 1000 м3/ч, а в некоторых случаях до 10000 м3/ч [12; 13].
Энергетические показатели адсорбционных безнагревных воздухоразделительных установок близки к соответствующим показателям установок ректификационного типа. В зависимости от чистоты получаемого газа
и величины максимального давления удельные энергозатраты в них составляют 0,5 — 1,1 кВт·ч/м3 [14]. При оптимизации энергозатраты могут быть снижены до 0,3 — 0,6 кВт·ч/м3 [12].
К основным достоинствам установок PSA можно отнести полную автоматизацию, небольшие габариты, быстрый запуск и остановку, низкую стоимость оборудования относительно установок низкотемпературной ректификации, простоту эксплуатации и длительный период безостановочной работы.
Основы и принцип действия установок адсорбционного разделения воздуха
Методы адсорбционного разделения воздуха разделяют на два типа осуществления процесса, главное отличие которых состоит в получаемом продукте и применяемом адсорбенте. При адсорбции на цеолитах происходит преимущественно селективная сорбция азота с концентрированием кислорода на выходе, в случае применения углеродных молекулярных сит (УМС) происходит поглощение кислорода с продуцированием азота высокой чистоты. Вклад в адсорбируемость азота и кислорода на цеолитах помимо дисперсионного взаимодействия вносит специфическая составляющая за счет взаимодействия квадруполей молекул газов с катионами цеолита, при этом вклад специфической составляющей при адсорбции кислорода в несколько раз ниже [15; 16]. Повышенная адсорбция кислорода на поверхности УМС объясняется меньшим размером молекулы кислорода по равнению с молекулой азота, то есть кинетическим эффектом.
Стандартная схема для получения кислорода по принципу PSA организована по типу установки Скарстрома. Схема состоит из двух адсорберов, попеременно работающих в режиме адсорбции и регенерации (Рисунок 2). Воздух при повышенном давлении подается в адсорбер 1, при этом лобовой слой адсорбента насыщается азотом. Фронт адсорбции перемещается в направлении пропускания воздуха, пока не произойдет насыщение сорбируемымкомпонентом (азотом). Часть кислорода, продуцируемого на выходе из аппарата, направляется на противоточную продувку адсорбера 2, работающего в режиме регенерации (Ратм). На второй стадии в аппарате 1 адсорбированный азот десорбируется при сбросе давления до атмосферного и удаляется из адсорбера, в то время как в адсорбере 2 набирается давление до давления адсорбции подачей воздуха. На третьей стадии аппарат 2 продуцирует кислород, при этом часть его поступает на противоточную продувку аппарата 1. На четвертой стадии давление в 2 сбрасывается, а в 1 поднимается, после чего цикл повторяется.
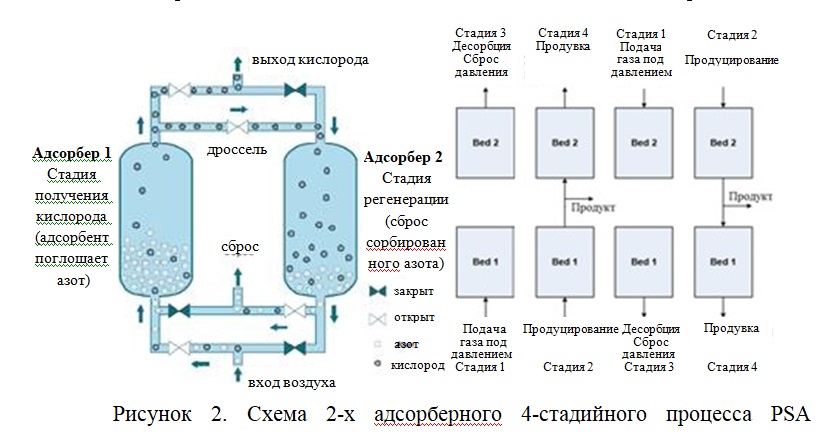
Одноступенчатая схема, приведенная на рисунке 2, позволяет получить
обогащенный по кислороду продуктовый поток. В аппарате для поглощения влаги и диоксида углерода применяют слой дополнительного адсорбента, а поглощение азота происходит в основном слое. Длительность цикла при данной схеме организации процесса составляет от нескольких секунд до нескольких минут.
Распространены три метода организации адсорбционного получения кислорода: напорные — Pressure Swing Adsorbtion (PSA), вакуумные – Vacuum Swing Adsorbtion (VSA) и смешанные — Vacuum Pressure Swing Adsorbtion (VPSA). В VSA кислород получают при атмосферном давлении, а
регенерацию проводят при пониженном давлении. Модифицирование и оптимизация организации адсорбционного цикла, а также получение более эффективных адсорбентов для азота позволило увеличить производство установок VSA. Для напорных схем продукционный газ производят при давлении выше атмосферного (порядка 5-7 атм), стадия регенерации же осуществляется при сбросе до атмосферного давления. В смешанных схемах сочетается изменение давления от повышенного, относительно атмосферного, до пониженного.
Предельная концентрация кислорода, которую возможно получить на установках, работающих по схеме PSA, не превышает 95,5 % об. Это связано с близкими величинами сорбции O2 и Ar.
Степень извлечения кислорода в настоящее время у мировых производителей равна 8,0-8,5 % для напорных схем и для схем с вакуумированием – 12 %. Степень извлечения кислорода равна отношению количества полученного продукционного газа к количеству затраченного воздуха, выраженному в процентах, и зависит от концентрации продуктового кислорода. Для получения кислорода применяются цеолиты разных типов, главным образом, типа Х и LSX.
Цеолиты для разделения воздуха
Цеолиты — это кристаллические алюмосиликаты щелочных или щелочноземельных металлов каркасной структуры, из которых путем умеренного нагревания вода может быть обратимо удалена без разрушения кремнеалюмокислородного каркаса; при этом в каркасе образуется система регулярных каналов и полостей, доступных для адсорбции молекул малых размеров. В промышленности синтез цеолитов был реализован английским химиком Баррером в конце 40-х годов XX в. Синтетические цеолиты более пригодны для промышленных целей, чем природные аналоги за счет своей однородной структуры и чистоты.
Химический состав цеолитов в упрощенном виде может быть представлен формулой: |Mx/n|×[(AlO2)x×(SiO2)y]×zH2O, где М – катионы с валентностью n (обычно это Na+, K+, Ca2+, Ba2+, Sr2+, Mg2+), z – число молекул адсорбированной воды, а отношение у/х – кремнеземный модуль адсорбента, который может изменяться в широких пределах от 1 (низкокремнистые цеолиты типа А и Х) до ∞ (кристаллические силикалиты). В последнем случае концентрация катионов M в цеолите стремится к нулю.
Цеолиты обладают строго регулярной кристаллической структурой. Каркас кристалла цеолита состоит из структурных первичных тетраэдрических элементов SiO4 и AlO4, соединенных между собой общими атомами кислорода. Каждый тетраэдр AlO4 несет отрицательный заряд, компенсирующийся внекаркасными катионами]. Важно отметить, что, согласно Ловенштейну, смежное расположение тетраэдров AlO4 в каркасе цеолитов невозможно из-за электростатического отталкивания отрицательных зарядов этих тетраэдров. Поэтому, отношение числа атомов кремния в каркасе цеолита к числу атомов алюминия не может быть меньше единицы. Каркасная структура цеолита, таким образом, включает внутрикристаллитные каналы или связанные между собой пустоты, в которых локализуются компенсирующие внекаркасные катионы, а также адсорбированные молекулы воды. В большинстве цеолитных структур первичные структурные блоки AlO4 и/или SiO4 объединены во вторичные, являющиеся простыми многогранниками, такими как кубы, гексагональные призмы или кубооктаэдры.
Порами в цеолитах называют n-членные кольца (n – число Т-атомов в кольце), образующие грани многогранников вторичных составных блоков. Размер пор цеолита может изменяться в диапазоне от 0,3 до 1,0 нм, а объем пор – от 0,1 до 0,35 см3/г. Можно классифицировать цеолиты относительно размеров пор на узкопористые цеолиты с порами в виде восьмичленных колец и диаметром 0,3 – 0,5 нм – это цеолит типа А; цеолиты со средним размером пор, образуемыми 10-членными кольцами размером 0,45 – 0,60 нм (ZSM-5) и крупнопористые цеолиты с порами, составленными из 12-членных колец, размером 0,6 – 0,8 нм (цеолиты типа X и Y) .
Многогранники, грани которых состоят менее чем из 6 тетраэдров, называют ячейками, так как их грани слишком узки для проникновения молекул размером большим, чем молекулы воды. Поры, неограниченно распространяющиеся в одном направлении и имеющие размер, достаточный для проникновения посторонних молекул (т.е. больше, чем 6-членные кольца), называются каналами. Различные типы цеолитных каркасов имеют одно-, двух- или трехмерную систему каналов.
Катионы в цеолитах типов X и Y находятся в 6 местах локализации (Рисунок 3).
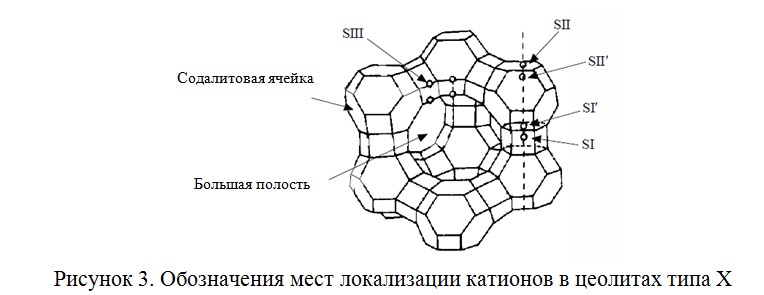
Ионы Na+ локализованы в местах SI, SI’, SII, SII’, SIII и SIII’ кристаллической решетки цеолита NaX в гидратированном виде, остальные катионы и молекулы воды проявляют свойства сильного электролита и способны свободно перемещаться в полостях цеолита. При дегидратации цеолитов удаляются молекулы воды, окружающие катионы, и возможно смещение катионов из исходных положений в положения вблизи кислорода каркаса.
Поскольку в процессе адсорбционного разделения воздуха на цеолитах газовая фаза обогащается по кислороду, необходимым требованием к адсорбентам является высокая емкость по азоту. Первоначально в 70-80-е годы XX в. для этих целей применяли цеолиты типов CaA и NaX. В дальнейшем было обнаружено, что высокой активностью по азоту обладают литиевые, кальциевые и стронциевые формы этих адсорбентов. Характеристики низкокремнистых фожазитов с соотношением Si/Al, равным 1,0-1,1 и различные теоретические аспекты их сорбционных свойств приведены в специальной литературе. К 1990-м годам XX века использование Li+-содержащих цеолитов типа LiX, LiMe2+X и LiMe3+X [41-44] значительно способствовало сокращению капитальных и энергетических затрат, благодаря росту выхода O2.
К макрокомпонентам воздуха относят азот, кислород и аргон (Таблица 1).
Таблица 1. Основные характеристики молекул N2, O2, Ar
| Газ | M, г/моль | Кинетический диаметр, Å | Квадрупольный момент, 26 2 10 , е×см |
| Ar | 39,948 | 3,542 | 0,0 |
| O2 | 31,999 | 3,467 | 0,39 |
| N2 | 28,014 | 3,640 | 1,52 |
Сделан вывод, что основное взаимодействие молекул О2 со структурой цеолита осуществляется с доступными внекаркасными катионами и кислородными атомами кристаллической решетки. Основанием к этому заключению могут служить значения теплот адсорбции при нулевом заполнении для N2, О2 и Аr на Na- и Н-морденитах (Si/Al=5,5), цеолитах А и Х, как показано в таблице 2.
В Na-мордените (ZM-060) с молекулами адсорбата взаимодействуют катионы Na+ за счет электростатических и поляризационных сил. Атомы кислорода решетки взаимодействуют с молекулами адсорбата за счет дисперсионных сил. Так как в цеолитах H-морденитах (ZM-210 и ZM–510) нет внекаркасных катионов Na+, то теплоты адсорбции отражают только дисперсионные взаимодействия между атомами кислорода цеолита и молекулами адсорбата.
Таблица 2. Теплоты адсорбции N2, О2 и Аr на цеолитах
| Цеолит | ΔН, кДж/моль | ||
| N2 | О2 | Аr | |
| Na-Морденит, (ZM-060) | 25,6 | 17,0 | 15,7 |
| Н-морденит (ZM-210) | 18,8 | 16,7 | 17,4 |
| Н-морденит (ZM-510) | 18,9 | 16,8 | 17,7 |
| NaХ | 18,5 | 12,0 | 11,2 |
| NaА | 19,6 | 13,8 | 11,9 |
Поэтому разница в теплотах адсорбции N2 и Аr показывает значение вклада электростатической составляющей в общую энергию взаимодействия N2 с цеолитом. Эта разница для N2 при адсорбции на цеолите ZM-060 = 9,9 кДж/моль (Таблица 2), по сравнению с 1,4 и 1,2 кДж/моль для ZM-210 и ZM–510, соответственно. Более высокая энергия взаимодействия для ZM–060 – следствие электростатического взаимодействия ионов Na+ с молекулами N2. Вклад энергии взаимодействия квадруполя N2 с изолированным ионом Na+ по теоретическим расчетам составляет 13,9 кДж/моль. Более низкое значение энергии, в случае, когда ионы Na+ находятся внутри цеолитовой полости, обусловлено экранирующим влиянием атомов кислорода решетки на ионы Na+. Значения теплот адсорбции аргона и кислорода на ZM–210 и ZM–510 показывают, что дисперсионные взаимодействия для Аr на этих цеолитах значительно выше, чем для О2. При сравнении данных по теплотам адсорбции для Na-форм цеолитов (Таблица 2) наибольший вклад электростатической составляющей при адсорбции азота наблюдали на Na-мордените, дисперсионные и поляризационные взаимодействия для которого также высоки.
Таким образом, при адсорбции на цеолитах различия в адсорбируемости азота и кислорода обусловлены тем, что кроме дисперсионных и поляризационных сил проявляется дополнительный вклад специфического взаимодействия квадруполей азота и кислорода с внекаркасными катионами цеолита. В отличие от азота молекула кислорода обладает существенно меньшим квадрупольным моментом, и поэтому вклад специфической
составляющей при адсорбции кислорода на цеолите в несколько раз ниже. Дисперсионные взаимодействия для Аr на цеолитах выше, чем для О2, поскольку он имеет большую молекулярную массу. Однако кислород адсорбируется как за счет дисперсионных сил, так и за счет специфического взаимодействия, и по сумме сил адсорбция кислорода на цеолитах такая же, как и у аргона
- Особенности адсорбции азота на цеолитах
Поскольку адсорбция азота обусловлена взаимодействием квадруполя молекулы с катионами цеолита, то решающее значение имеет количество доступных катионов и их плотность заряда (e) в цеолите, то есть отношение заряда катиона – Z к его радиусу – r: e=Z/r2 . Доступность катионов для адсорбции зависит от особенностей кристаллической структуры данного типа цеолита, а также от общего числа катионов: чем оно больше, тем больше катионов будет располагаться в доступных местах. Вследствие чего значительным достижением в области синтеза адсорбентов для разделения воздуха является синтез низкокремнистого цеолита Х (LSX), кремнеземный модуль (Si/Al) у которого равен 1, по сравнению с модулем обычного цеолита Х, равного 1,25-1,50.
В цеолите типа Х литий преимущественно занимает места SI’ и SII. Li+-ион, благодаря своему малому размеру (0,68 Å), располагается почти в плоскости 6- ти членного кольца, в то время как более крупный катион Na+ (0,95 Å) держится выше плоскости кольца в тригонально-пирамидальной координации, состоящей из молекул О2 [41; 51]. В результате, катионы Li+ в местах SII менее доступны для адсорбатов, чем катионы Na+ в этих же местах и проявляют более слабые взаимодействия и более низкие значения теплот адсорбции. Только при полном замещении Na+-катионов в местах SII, ионы Na+ в местах SIII или в нелокализованных позициях замещаются ионами Li+ и наблюдается резкий рост теплот адсорбции.
Катионы Li+ в местах SIII локализованы на поверхности больших полостей цеолита Х и находятся в свободном состоянии, поэтому могут формировать вокруг себя сильное электростатическое поле. Катионы в местах SIII являются предпочтительными центрами для адсорбции азота. Катионы Li+ в местах SI и SII занимают термодинамически устойчивое состояние и практически не принимают участия в адсорбции. При степени обмена на Li+ менее 80 % все катионы Li+ располагаются в местах SI и SII, содержание Li+ в местах SIII равно 0 и величина адсорбции низка. При степени обмена на Li+ более 80 % катионы Li+ начинают размещаться в местах SIII, и адсорбция азота резко возрастает.
Измерены изотермы адсорбции N2 и О2 при температурах 25 и 50 °С на цеолитах LiX, AgX и LiAgX (20%). Цеолит AgX термостабилен, и изотермы адсорбции N2 не изменяются после длительного прокаливания цеолита на воздухе при 350 °С. По мнению авторов, азот связан в цеолите AgX сильнее, чем в других ионообменных формах цеолита Х. Высокая энергия адсорбции (8,4 ккал/моль) и низкая скорость десорбции N2 из цеолита AgX свидетельствуют об образовании p-комплекса, что подтверждается расчетами для модельных систем. Высокая селективность, полученная для цеолита AgX при низких давлениях, объясняется затрудненной десорбцией N2, и поэтому цеолит AgX не пригоден для разделения воздуха. Для цеолита LiAgX коэффициент разделения в области высоких давлений выше, а в области низких давлений ниже, чем для цеолита LiX. Это свойство цеолита LiAgX, в сочетании с его более высокой адсорбционной емкостью по азоту, делает цеолит LiAgX перспективным адсорбентом для разделения воздуха.
Работа [53] посвящена подготовке и определению адсорбционных характеристик цеолита LiLSX. На основе адсорбции азота при комнатной температуре и литературных данных по дифракции нейтронов авторами было сделано заключение об одновременной локализации катионов Li+ в смежных позициях I и I’ решетки цеолита [53]. Избыток катионов лития (Li/Al>1) в цеолите не влияет на адсорбционные свойства образцов по кислороду при комнатной температуре.
Изучение адсорбционных характеристик на коммерческом образце цеолита типа LSX демонстрирует высокую селективность по отношению к азоту (Таблица 3).
Таблица 3. Константы Генри, теплоты адсорбции и Kp для N2, O2 и Ar на LiLSX
| Т, К | K, моль/кг/атм | q0, ккал/моль | Кр O2-Ar | Кр N2-O2 | ||||
| Ar | O2 | N2 | Ar | O2 | N2 | |||
| 273,1 | 0,262 | 0,300 | — | — | — | — | 1,15 | — |
| 328,1 | — | 0,110 | 0,611 | — | — | — | — | 5,55 |
| 303,1 | 0,156 | 0,157 | — | 2,75 | 3,22 | 5,87 | 1,01 | — |
| 338,1 | 0,098 | 0,096 | 0,458 | — | — | — | 0,98 | 4,77 |
Слабо адсорбирующиеся вещества, такие как азот и кислород чувствительны к содержанию воды в цеолитах. Как показали ранее проведенные исследования, адсорбционные свойства цеолитов по азоту и кислороду определяются условиями подготовки и хранения адсорбентов. В работах было показано, что присутствие воды и СО2 в воздухе, поступающем на разделение, отрицательно сказывается на адсорбционной емкости и селективности адсорбентов по азоту. Диоксид углерода может физически сорбироваться или хемосорбироваться на цеолитах, снижая их адсорбционные свойства по другим адсорбатам. Влияние предварительно адсорбированной воды объясняют гидроксилированием двухвалентных катионов. При этом протекает реакция гидратации:
Mn+ + xH2O MOH+(n-e) + eH+ + (x-e)H2O
где M – катион, n – его валентность (2 или 3), x =1-6 и e =1-2. Продукты реакции снижают адсорбционную ёмкость цеолита и его стабильность. Гидроксилированные многовалентные катионы, такие как CaOH+, не являются местами селективной адсорбции N2. Кроме того, цеолитная решётка нестабильна по отношению к H+-ионам. Равновесие может быть сдвинуто влево путём
минимизирования количества воды, присутствующей в цеолите при каждой данной температуре, особенно выше 150 °С, во время активации.
Исследовано влияние температуры дегидратации [56; 59] на содержание остаточной воды в цеолитах различных типов и равновесную адсорбцию азота и кислорода, показало, что у всех цеолитов с ростом температуры содержание остаточной воды понижается, но темпы и предельные величины понижения выражены неодинаково. У цеолитов СаА, СаE, СаLSX содержание воды, например, при 400 °С значительно превышает содержание воды в цеолите NaX при 200 °С. Снижение содержания остаточной воды по-разному проявляется в разных цеолитах. Оно приводит к равновесному росту адсорбции азота и кислорода на цеолите СаЕ, к росту емкости по кислороду и снижению емкости по азоту для цеолита NaX и незначительному увеличению емкости по кислороду для цеолита CaX.
Поскольку адсорбция воды в цеолитах в первую очередь и с самыми высокими значениями теплоты адсорбции протекает именно на катионах, то вода является сильным конкурентом азоту при занятии активных центров сорбции. Присутствие воды в воздухе, поступающем на разделение, отрицательно сказывается на адсорбционной емкости и селективности адсорбентов по азоту. Однако, как считают, молекулы воды, введенные извне в дегидратированный цеолит X, влияют на адсорбцию N2 менее существенно, чем остаточные после дегидратации, из-за гетерогенности адсорбционных центров и диффузии воды в цеолите. Кроме того, во время дегидратации цеолита катионы могут смещаться из тех положений, в которых они были окружены молекулами воды, в положения вблизи кислорода решетки, недоступные для молекул азота.
Результаты экспериментов по дегидратации цеолита NaX в атмосфере осушенного (CH2O < 0,12 г/м3) и влажного воздуха (CH2O ~ 14 г/м3) при 100 -500 оС приведены на рисунке 4 .
Остаточное влагосодержание адсорбента монотонно зависит от температуры прокаливания и снижается с ее повышением. Равновесная емкость
по кислороду от температуры прокаливания имеет аналогичную зависимость. Характер зависимости равновесной емкости по азоту от температуры прокаливания цеолита NaX более сложный: экстремальная точка, при которой наблюдали наибольшее значение емкости по азоту, соответствует 400 °C.
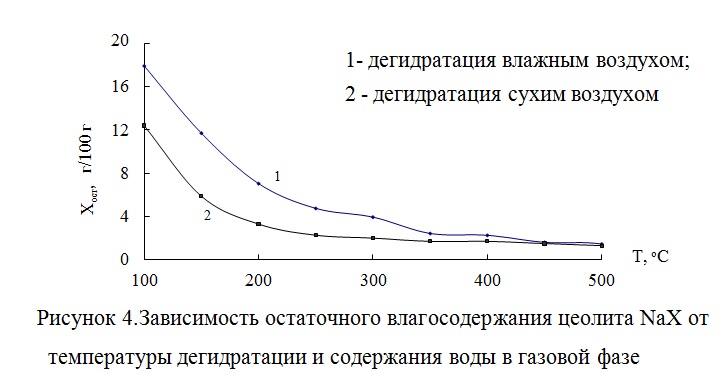
При минимальном значении остаточного влагосодержания, которое было достигнуто при 550 °С, наблюдали снижение адсорбции азота и максимальный рост адсорбции кислорода. У цеолитов LiX и LiMgX с ростом температуры дегидратации и снижением Хост наблюдали постепенное увеличение равновесной адсорбции азота, сопровождающееся ростом адсорбции кислорода [61; 62].
Результаты опытов [62] говорят о том, что содержание воды в структуре цеолита является важным фактором, определяющим его емкость по тому или другому газу. Также значение имеет перемещение катионов в структуре цеолита, в частности, их миграция в содалитовые ячейки и гексагональные призмы при высоких температурах и высоких степенях дегидратации [57].
В работе [35] определено влияние остаточного влагосодержания на адсорбцию компонентов воздуха в цеолитах LiX, LiAgX и AgX. Даже небольшое количество воды в цеолите LiLSX существенно снижает величину адсорбции азота.
Для сохранения адсорбционных свойств цеолитов необходима дегидратация непосредственно после их получения, а также хранение в безводной атмосфере [61].
Таким образом, предварительная подготовка адсорбентов перед загрузкой в адсорберы установок разделения газов является очень важной операцией, обеспечивающей высокую степень разделения и высокую чистоту продукта. В силу высокой активности цеолитов по парам воды их дегидратация проводится при высоких температурах, тем не менее, остаточное влагосодержание в твердой фазе может быть достаточно большим и влиять на адсорбцию слабо сорбирующихся газов: азота и кислорода.
Поскольку практически на всех типах цеолитов адсорбционные емкости по кислороду и аргону одинаковы, поэтому при обогащении воздуха кислородом чистотой до 95 % одновременно происходит его обогащение аргоном практически до 4,6 %, что ограничивает применение адсорбционных методов. Вместе с тем высокочистый кислород (более 99 %) требуется в различных областях промышленности [63].
Например, при газовой резке стали снижение концентрации кислорода на один процент приводит к снижению скорости реза в 2 раза, а при концентрации кислорода ниже 90 об. % рез практически невозможен вследствие образования большого количества грата. Кроме того, при снижении концентрации кислорода приходится увеличивать его давление для выдувания расплава и продуктов окисления. При этом увеличивается расход кислорода, а резка стали толщиной свыше 300 мм может производиться лишь кислородом с концентрацией не менее 99 об. % [63].
При лазерной резке конструкционных и низколегированных сталей требования к чистоте кислорода возрастают, так как кислород с концентрацией ниже 99,5 об. % не позволяет получать качественный рез без грата. Чистота кислорода имеет ключевое значение, и дополнительное увеличение скорости
реза возможно исключительно за счет использования более чистого кислорода с чистотой не ниже 99,9 %. Применение кислорода чистотой 99,95 % по сравнению с обычным (99,5 %) позволяет увеличить скорость лазерной резки на
25 %. Наиболее целесообразно и экономически оправдано применение при машинной кислородной резке кислорода чистотой не менее 99,2% [64]. Присутствие в дутье балластного инертного газа приводит к понижению скорости окислительных и восстановительных процессов и непроизводительному увеличению мощности воздуходувных средств, а следовательно, к увеличению капитальных затрат и эксплуатационных расходов. Таким образом, разработка адсорбционных процессов, позволяющих получать кислород с концентрацией 99 об. % и выше, является насущной задачей. Поэтому синтез адсорбента, эффективного в разделении кислорода и аргона является очень перспективной целью. Создание такого адсорбента значительно увеличит возможности адсорбционных процессов получения
кислорода высокой чистоты.
В 2002 году компании «Air Products and Chemicals Inc.» запатентовали цеолит AgLiLSX, селективный к аргону, для установки PSA/VPSA (Pраб – 0,34 – 1,4 бар при 38 °С) по производству кислорода высокой чистоты из воздуха [65]. По данным работы, получение цеолита, селективного к аргону, возможно путем поочередного ионного обмена сначала с катионами лития, затем катионами серебра, при этом содержание серебра в цеолите должно быть от 30 до 60 мас.%. В соответствии с результатами, согласно патенту, AgLiLSX позволяет получать кислород чистотой выше 97%.
Более сложное технологическое решение для производства кислорода высокой чистоты из воздуха [66] предполагает двухстадийный процесс, где на первой стадии получают 95%-ный кислород (PSA), а на второй происходит доочистка от аргона либо на мембранных модулях, либо на углеродных
молекулярных ситах. Согласно результатам моделирования, мембранный модуль способен производить кислород концентрацией 99,5 об.%.
По данным работ [67-69] при использовании УМС для дополнительной очистки от примеси аргона возможно получение кислорода с концентрацией не менее 99 об. %. Разделение смеси кислород-аргон на УМС основано на различиях в скорости адсорбции кислорода и аргона: скорость адсорбции кислорода значительно выше, чем аргона, поэтому кислород задерживается в порах адсорбента, а газовая фаза обогащается аргоном. Как было показано в работах [67; 70] на УМС марки Bergbau-Forschung MSC (BF-MSC), адсорбция O2 происходит почти в 30 раз быстрее, чем Ar.
Cравнительный анализ изотерм разных типов адсорбентов (Рисунок 5), включая углеродные молекулярные сита, активированные угли, цеолиты типов А и X и титаносиликаты. Наибольшую активность практически все исследованные адсорбенты проявили по отношению к кислороду и были рекомендованы авторами для его выделения.
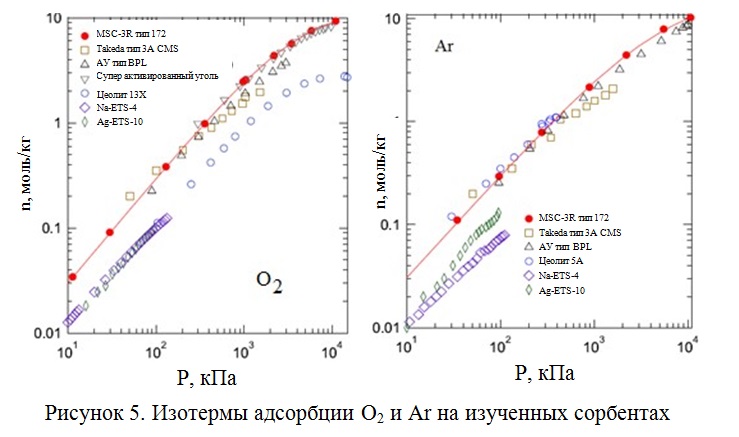
Однако, поскольку аргона в кислородообогащенном потоке до 5 об. %, то
для удаления этой примеси (и выделения аргона в концентрированном виде) более актуален поиск высокоактивных адсорбентов в отношении аргона.
Основные успехи в получении адсорбентов, селективных к аргону, так или иначе, связаны с серебросодержащими цеолитами.
В патенте [72] для разделения смеси кислорода и аргона методом PSA в качестве замыкающего слоя адсорбента предложено использовать Ag-морденит, содержащий от 5,5 до 12 мас. % серебра. Лучший результат по концентрации кислорода в продукте получен при температуре не ниже 60 °С и давлении адсорбции 10,7 атм. Основной слой представлен цеолитами NaX или СаА, концентрация кислорода в этой схеме достигает 99,7 %.
Об исследованиях свойств природных цеолитов, в частности морденитов Армении и их модификаций, сообщается в [73; 74]. Показано, что природный морденит может быть с успехом применен для разделения воздуха и получения O2, N2 и Ar. На Ag-мордените, полученном из природного морденита, кислород адсорбируется лучше, чем аргон, что, по мнению авторов, связано с уменьшением размера пор у модифицированного образца.
Авторами [16] проводились исследования адсорбционной активности газов на синтетическом мордените NaM (Si/Al – 5,9; а Na/Al – 1,1), модифицированном путем деалюминирования и катионного обмена. Среди образцов Li-, Ag-, Ca-, Sr- и BaNaM селективность к аргону проявил лишь образец AgNaM со степенью ионного обмена 93,5% (Таблица 4).
Таблица 4. Зависимость равновесной емкости по газам от степени ионного обмена ионов натрия на ионы серебра в цеолите AgNaM
| Степень обмена, % | Равновесная адсорбция при 25 °С и 0,1 МПа, см3/г | ||
| азота | кислорода | аргона | |
| 0 | 7,5 | 3,6 | 3,6 |
| 27,1 | 10,1 | 7,0 | 5,1 |
| 52,0 | 8,3 | 6,4 | 5,1 |
| 86,0 | 8,9 | 5,4 | 4,5 |
| 93,5 | 2,7 | 3,2 | 4,4 |
Помимо морденита появились сведения о других серебросодержащих типах цеолитов, имеющих некоторую селективность в отношении аргона [75; 76]. Для получения 97 % об. кислорода в патенте [65] предлагается использовать цеолит AgX со степенью обмена 20-70%.
В работе [75] приведен обзор по серебросодержащим типам цеолитов: А, Х, Y, BEA, L, морденит, ZSM-5 при 30 °С. Несмотря на то, что Na- и Ag-формы цеолита содержат одинаковое количество катионов, значение коэффициента разделения (a) смеси N2/O2 намного выше для Ag-формы цеолита в области низкого давления (Таблица 5).
Таблица 5. Адсорбционная селективность цеолитов разных типов при Р=1 бар
| Цеолит | Натриевая форма | Серебросодержащая форма | ||||
| α (N2/O2) | α (N2/Ar) | α (Ar/O2) | α (N2/O2) | α (N2/Ar) | α (Ar/O2) | |
| Тип А | 3,0 | 3,2 | 0,93 | 5,1 | 3,9 | 1,63 |
| Тип Х | 3,1 | 3,3 | 0,93 | 3,2 | 2,9 | 1,11 |
| Тип Y (5,5) | 3,4 | 3,7 | 0,91 | 3,0 | 2,7 | 1,12 |
| Тип L | 1,7 | 1,7 | 1,00 | 2,2 | 2,1 | 1,04 |
| BEA | 1,3 | 1,3 | 0,98 | 1,8 | 1,7 | 1,07 |
| Морденит 060 | 2,9 | 2,8 | 1,02 | 3,5 | 2,8 | 1,22 |
| Морденит 510 | 1,1 | 1,0 | 1,07 | 1,6 | 1,4 | 1,13 |
| ZSM-5(25)* | 1,9 | 1,8 | 1,02 | 1,9 | 1,6 | 1,65 |
| ZSM-5(40) | 1,7 | 1,6 | 1,05 | 1,6 | 1,5 | 1,25 |
| ZSM-5 (100) | 1,6 | 1,5 | 1,04 | 1,6 | 1,4 | 1,23 |
| ZSM-5 (400) | 1,3 | 1,3 | 1,05 | 1,2 | 1,2 | 1,15 |
| ZSM-5 (900) | 1,2 | 1,2 | 1,03 | 1,1 | 1,1 | 1,05 |
| * в скобках указан кремнеземный модуль цеолита | ||||||
Серебросодержащие цеолиты вне зависимости от типа также показывают увеличение в селективности по отношению к аргону, особенно в области низкого давления. AgZSM-5 [75] и образцы AgA показывают высокие значения 1,65 и 1,63, соответственно. При одинаковом значении заряда, большем размере иона (1,26 Å) и более низкой плотности заряда катионов серебра по сравнению с
| 2pz |
| 2py |
катионами натрия (0,97 Å), серебросодержащие цеолиты показывают более сильные взаимодействия с молекулами азота. Например, селективность азота и величины теплоты адсорбции у всех серебросодержащих цеолитов выше по сравнению с Na+ или Са2+ формами. Это наблюдение противоречит расчетным значениям электростатических взаимодействий между изолированными Na+, Ag+ и Са2+ и индуцированным диполем молекулы азота, в соответствии с рядом: Са2+ (118,0 кДж/моль)> Na+ (31,5 кДж/моль)> Ag+ (19,7 кДж/моль). Более высокие теплоты адсорбции для N2, которые наблюдали для всех серебряных форм цеолитов, могут быть объяснены с точки зрения π-комплексообразования молекул азота с ионами серебра, присутствующими внутри полостей цеолита. Согласно электронной формуле молекулы N2:
| 2py |
[KK (s2s)2 (s2s*)2 (s2px)2 (π2
)2 (π2
)2 (π2
*)0(π22pz*)0] и Ag+ [Kr 4d10 5s0]
| ) (π |
показано, что существуют высшая занятая (ВЗМО) и низшая свободная (НСМО) молекулярные орбитали π2p и π2p*, сотственно. Для ионов серебра в составе цеолита полностью занята 4d орбиталь и свободна 5s орбиталь. Таким образом, разница в энергиях между НСМО и ВЗМО азота составляет около 8 эВ, что позволяет облегчить перенос электронов с π2p орбитали N2 на орбиталь 5s Ag+ и обратный перенос с 4d орбитали катиона серебра на свободную орбиталь π2p* молекулы азота и способствует образованию π-комплекса. Это, в свою очередь, приводит к более сильному взаействию между серебросодержащим цеолитом и молекулой азота. Электронная формула молекулы O2: [KK (s2s)2
содержит 2 разрыхляющих электрона,
что затрудняет образование π-комплекса. Наблюдаемую селективность к аргону для серебросодержащих цеолитов можно объяснить специфическими взаимодействиями за счет перекрытия орбиталей Ar (ps) -Ag (ds) .
Особые адсорбционные свойства серебряных форм цеолитов по отношению к аргону (и другим инертным газам) связывают с образованием кластеров серебра внутри полостей цеолитов. В Аg-формах цеолитов при нагревании ионы серебра взаимодействуют друг с другом, образуя кластеры и группировки, состоящие из атомов серебра и Ag-ионов. Кластеры могут занимать разнообразные места в цеолитной структуре. Эта изменчивость в составе и расположении кластеров приводит к модификациям цеолитов, обладающих различающимися адсорбционными свойствами.
В литературе сообщается о синтезе новых цеолитоподобных адсорбентов для разделения кислорода и аргона, например, молекулярном сите из силиката титана и его ионообменных модификациях. Изучена адсорбция аргона, кислорода и азота на титаносиликатном молекулярном сите ETS-10 с обменными ионами серебра и на Ag-мордените. Коэффициент разделения смеси аргон-кислород, рассчитанный по изотермам адсорбции аргона и кислорода, как соотношение констант Генри, составил для Аg-морденита 1,25; а для ETS-10 с обменными ионами серебра – 1,5, при этом коэффициент разделения N2-O2 был равен 2,8. Концентрация продуктового кислорода, полученного в этой работе, составляет 99,7 об %.
Помимо серебросодержащих цеолитов, разделение кислорода и аргона при комнатной температуре изучали на титаносиликате Ba-RPZ (Reduced Pore Zorite), подобный зориту. При комнатной температуре изотермы адсорбции и изостерические теплоты адсорбции для кислорода и аргона на Ba-RPZ были практически идентичны, но наблюдалась небольшая термодинамическая селективность адсорбции в отношении кислорода (~ 1,1 – 1,2) (Рисунок 6).
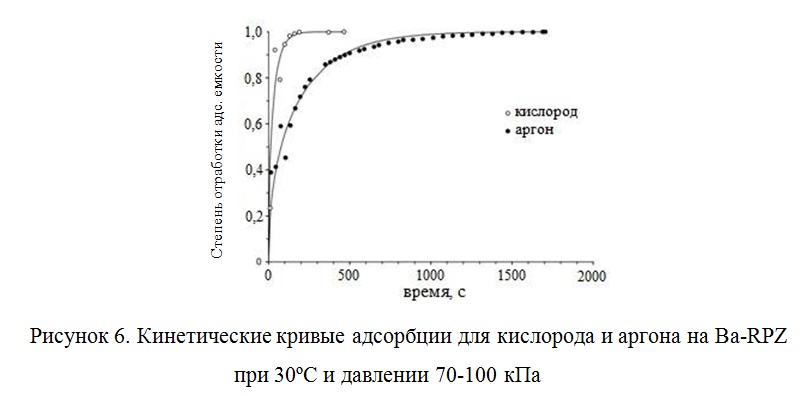
Как следует из кинетических кривых, скорость сорбции кислорода была выше, чем аргона. Это указывает на возможность разделения смеси аргон- кислород, основываясь на ситовых свойствах адсорбента и отличиях в размерах молекул O2 и Ar. Определенным образом ориентированная молекула кислорода имеет меньший критический (кинетический) диаметр, чем диаметр молекулы аргона, несмотря на множество работ, в которых приведены другие данные (Таблица 6).
Большинство литературных источников приводят значения кинетических диаметров для О2 и Ar, из которых следует, что разница в размерах между кислородом и аргоном она слишком мала, чтобы объяснить молекулярно- ситовой эффект [79].
В работе [79; 80] предложен подход, который учитывает не только размер молекул и размер пор, но и их форму. Набор параметров для каждого адсорбата рассматривается на основе квантово-химических расчетов. Размер молекул характеризуется величиной эффективного кинетического диаметра (Таблица 6).
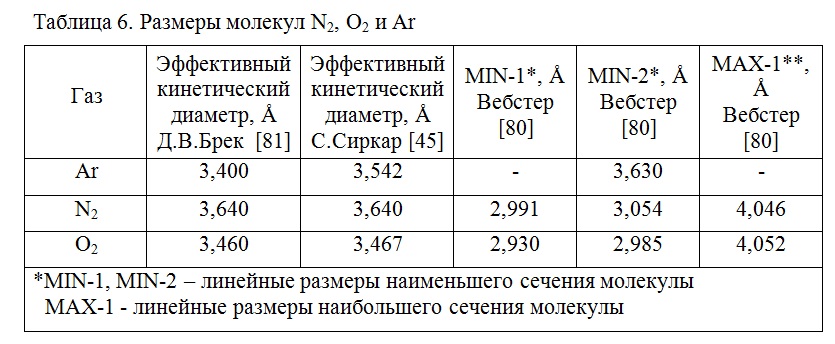
Из данных таблицы 6 видно, что эффективный кинетический диаметр молекулы не является абсолютной размерной характеристикой и требуется учитывать геометрию молекулы. Рассчитанные значения MIN-2 для O2 и N2 гораздо меньше, чем их эффективные кинетические диаметры.
Согласно этой модели, наблюдаемое поглощение О2 цеолитом Ba-RPZ
объясняется ориентированным взаимодействием между окном цеолита и молекулой О2. Ориентация аргона, напротив, не имеет значения. Вследствие определенной ориентации О2 кинетически предпочтительна адсорбция кислорода.
Введение катионов церия и стронция в цеолит типа Х приводит к повышению их селективности по отношению к кислороду из его смеси с аргоном и/или азотом. Так, в работах [82] путем ионного обмена с раствором хлорида церия (III) получали образцы адсорбента и активировали их в токе водорода при 400 °С, 12 ч. В таблице 7 приведены состав адсорбентов и коэффициенты разделения по макрокомпонентам воздуха, рассчитанные по величинам адсорбций чистых компонентов.
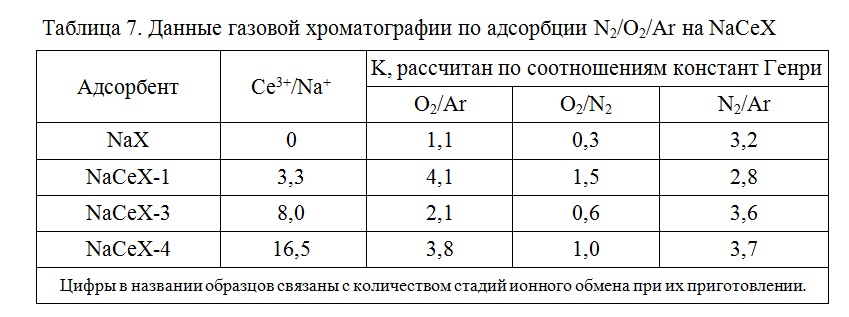
Большую активность к кислороду проявил цеолит NaCeX, изотермы адсорбции газов для которого приведены на рисунке 7.
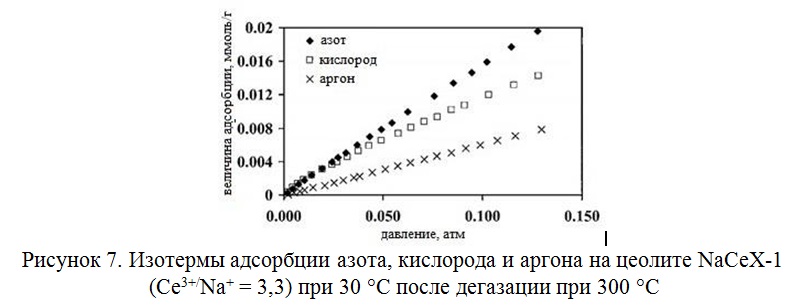
ППриведены данные по адсорбции компонентов воздуха при атмосферном давлении и температуре 30 °С на цеолитах типа Х, модифицированных ионами щелочноземельных металлов (Таблица 8).
Таблица 8. Результаты адсорбционных измерений на цеолитах NaX, модифицированных щелочноземельными металлами.
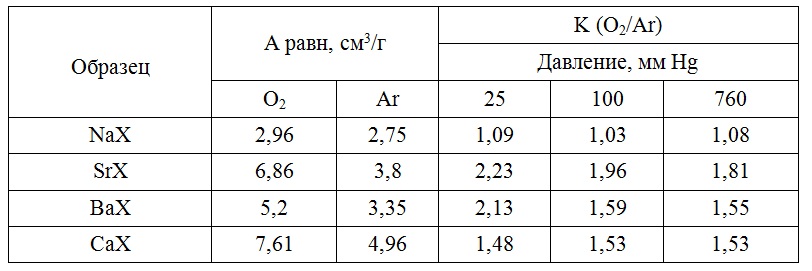
Полученный цеолит SrX ионным обменом катионов натрия на двухвалентные катионы стронция. На рисунке 8 и в таблице 9 приведены сравнительные данные значений констант Генри (Г) и коэффициента селективности (α) разделение смеси O2-Ar. Наименьшим значением (α) обладал образец SrX.
Наибольшую селективность к кислороду среди модифицированных адсорбентов показал цеолит SrX.
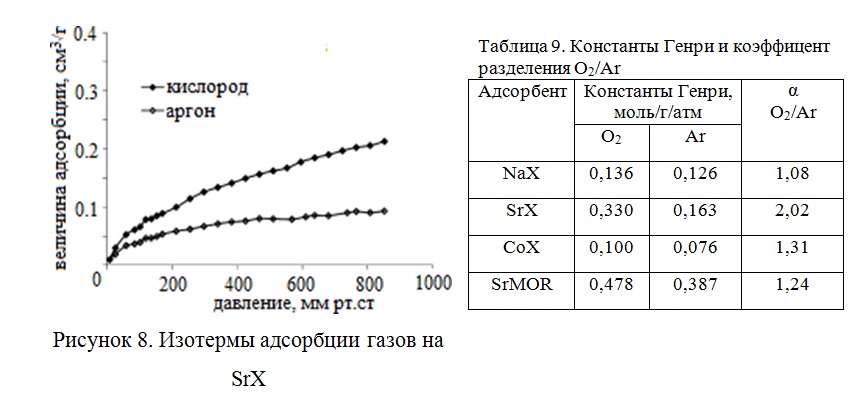
Есть результаты по разделению воздуха на образцах цеолита NaX, модифицированных ионами металлов группы лантаноидов (Сe, Eu и Gd) с помощью ионного обмена и последующим активированием в вакууме. Увеличение содержания церия в цеолите позволило получить максимальный коэффициент селективности O2/Ar, равный 8 для CeNaX84. В таблице 10 приведены адсорбционные емкости образцов по кислороду и коэффициенты разделения по макрокомпонентам воздуха.
Таблица 10. Результаты
адсорбционных измерений на цеолитах NaX, модифицированных металлами группы лантаноидов
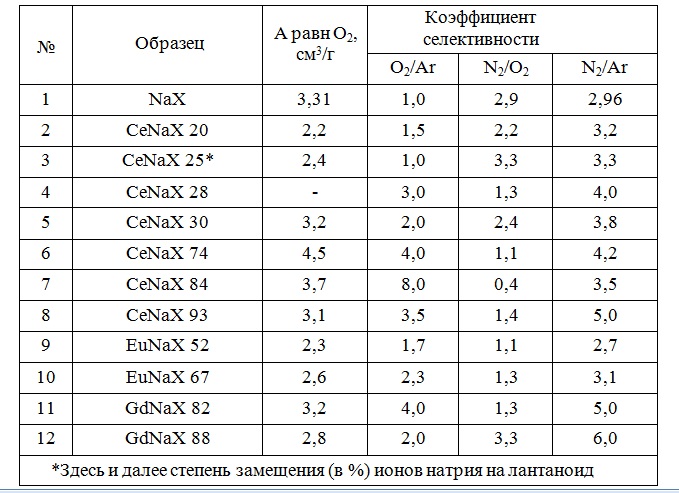
На рисунке 9 представлены изотермы адсорбции по азоту, кислороду и аргону для образца CeNaX 84 в диапазоне давлений от 0 до 850 мм Hg. В области низких давлений (до 400 мм Hg) адсорбция кислорода превышает величину адсорбции N2.
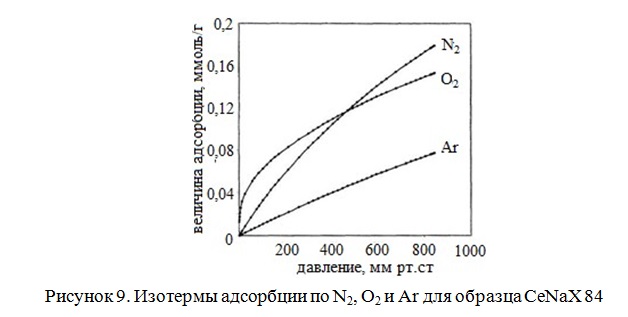
В промышленности аргон высокой чистоты получают с помощью низкотемпературных адсорбционных процессов (cryogenic temperature swing adsorption – CTSA). Неочищенный сырой аргон подается в адсорбционные колонны, заполненные различными комбинациями адсорбентов, селективных к азоту и кислороду. Процесс проводится при температуре, лежащей в интервале между точкой кипения смеси и точкой росы для этой смеси. В качестве адсорбента, селективного к азоту, использовались цеолиты типа X или мордениты, а для сорбции кислорода применялся слой из УМС или цеолит типа 4A. После адсорбции дальнейшая очистка аргона проводится каталитическим гидрированием остатков кислорода.
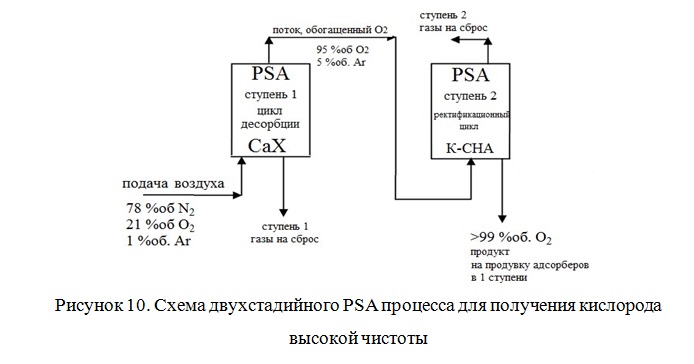
Ранее был синтезирован шабазит с соотношением Si/Al=2,4, а также проведен ионный обмен с введением ионов К+, Li+ и Са2+. К-шабазит показал лучшую селективность O2/Ar, чем Ca-шабазит. Высокая избирательность O2/Ar, возможно, возникает из-за частичного блокирования пор в результате большого размера катиона калия, расположенного рядом с 8-ми членным кольцом, ведущим к 20-гранной ячейке. К-шабазит может быть использован для производства кислорода высокой чистоты в простой двухступенчатой системе PSA (Рисунок 10). На первом этапе получают смесь из 95 %об. O2, 5 % об. Ar при использовании CaX. На втором этапе, где адсорбентом является К-шабазит, предполагается получать кислород концентрации более 99 % об. на стадии вакуумной регенерации.
- Адсорбция N2, O2, Ar на модифицированных монтмориллонитовых глинах
Большой интерес в качестве адсорбента приобретают пилларированные монтмориллонитовые глины. Адсорбция компонентов воздуха на пилларированных глинах в качестве сорбента была впервые изучена Янгом и Бакше]. Они обнаружили, что коэффициент разделения азот – кислород на этом сорбенте составляет около 2.
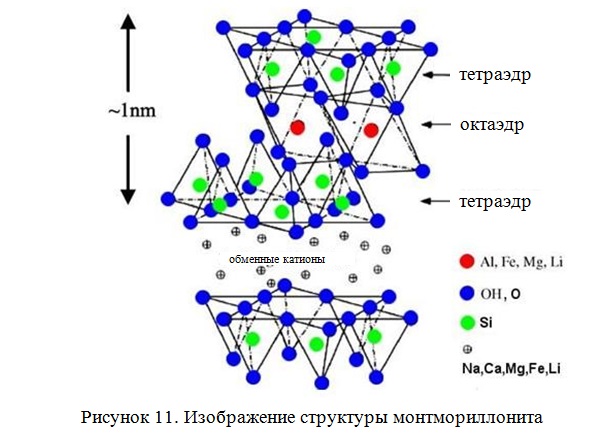
Монтмориллонит – это основной глинистый минерал в группе бентонитов со структурой 2:1 . Структура представляет собой отдельные пакеты, связанные между собой. Пакет кристаллической решетки состоит из двух тетраэдрических кремнекислородных SiO4 (Т-сетка) между которыми одна октаэдрическая Аl или Mg кислородно-гидроксильная сетка (0-сетка) все сетки пакета имеют примерно равные размеры и образуют связанные слои
(Рисунок 11). Элементарная ячейка монтмориллонита включает 20 атомов кислорода и четыре гидроксильные группы и состоит из восьми кремнийкислородных тетраэдров и четырех алюминийсодержащих октаэдров.
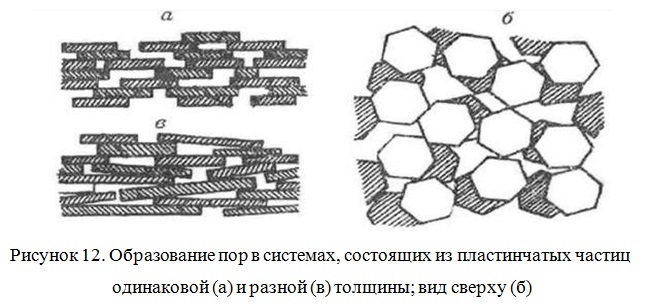
Межплоскостное (межпакетное) расстояние в монтмориллоните не является жестким и в зависимости от содержания воды в глине и состава обменных катионов может варьировать от 0,96 нм в сухом состоянии до 14 нм во влажном. Монтмориллонит характеризуется бидисперсной структурой (Рисунок 12). Структура пор монтмориллонита образована первичными щелевидными порами переменной ширины в пластинчатых частицах и вторичными, представляющими собой пространство между ними.
В межпакетном пространстве располагаются обменные катионы (Na+, К+ или Са2+), а также молекулы воды, которые предотвращают слипание слоев.
Высокая емкость обмена катионами у монтмориллонита связана с двумя основными факторами. Кристаллическая решетка монтмориллонита изначально электрически неуравновешенна, кроме того, в ней всегда происходят изоморфные замещения: в тетраэдрической сетке Si замещается на Al; в октаэдрической сетке Al на Mg, Fe, Zn, Ni, Li [98; 99]. Способность вытеснять противоионы уменьшается в соответствии с рядом Гедройца: А13+>Ва2+>Са2+>Mg2+>К+>NH+>Na+>Li+. То есть, адсорбционная способность увеличивается с возрастанием заряда иона, в случае равнозарядных ионов с уменьшением заряда гидратированного иона [98]. Изоморфные замещения, в свою очередь, приводят к возникновению избыточного отрицательного заряда, сосредоточенного в октаэдрических слоях, распределенного по всем атомам кислорода [92; 100].
Между пакетами может свободно проникать вода и раздвигать их. На расстояние между отдельными пакетами влияют количество ОН-групп на базальной поверхности слоев, тип и количества обменных катионов, размер вклинивающихся молекул веществ.
Расчетным путем было получено [101], что при отсутствии обменных ионов введение воды в межпакетное пространство способствует возрастанию
«набухаемости» монтмориллонитовой глины при увлажнении. При наличии обменных катионов их тип является определяющим фактором, влияющим на
«набухаемость», так, катионы Na+ и К+ обеспечивают переход глины в состояние неограниченного разбухания, катионы Cа2+ и Mg2+ ограничивают способность монтмориллонита к поглощению влаги. Обменные катионы щелочных и щелочноземельных металлов способны эквивалентно и обратимо замещаться на катионы из модифицирующих растворов. Другим источником обменных центров являются слабокислые гидроксильные группы (Si-OH) и основные (Аl-OН) на боковых гранях и ребрах, которые в зависимости от рН участвуют в ионном обмене. Обменные катионы в межпакетном пространстве, гидроксильные группы и сорбированные молекулы воды выступают в роли активных центров, что способствует применению монмориллонитовых глин в качестве адсорбентов.
Процесс введения дополнительных групп и элементов называется интеркалированием [102]. Этот метод эффективно используется для модифицирования текстурных характеристик глин, создания в них развитой сети микропор, придания им термостабильности. Результатом интеркалирования является возникновение новых структур, содержащих помимо слоев исходной глины, слои, состоящие из введенных катионов или веществ]. Большая часть обменных катионов локализованы в межпакетном пространстве, а некоторое их количество, приблизительно 20%, располагаются на дефектах кристалла монтмориллонита .
В исследование морфологии частиц природных Таганских монтмориллонитов методом ПЭМ высокого разрешения показало, что кальциевая форма монтмориллонита (CaMМ) представляет собой скопление агрегатов из равномерных тонкодисперсных чешуйчатых частиц, частицы натриевой формы (NaM) имеют удлиненную брусковидную форму (Рисунок 13). Различие морфологических форм обусловлено строением октаэдрического слоя и содержанием в нем катионов Fe3+ и Mg2+.

Модифицирование монтмориллонита
Частным случаем интеркалирования является метод пилларирования. В результате обмена межслоевых катионов глины на полигидроксокатионы различной природы (Al3+, Fe3+, Ti4+, Zr4+ и др) значительно улучшается пористая структура материала и увеличивается его удельная поверхность. После термообработки комплексные катионы переходят в наноразмерные оксидные столбики металлов, которые действуют как опоры между силикатными слоями, фиксируя их на определенном расстоянии друг от друга. Глины, модифицированные таким образом, называются пилларированными (столбчатыми). Схема процесса пилларирования показана на рисунке 14. Его можно свести к трём основным стадиям:
- Приготовление модифицирующего раствора;
- Ионный обмен;
- Термообработка материала.
Единой точки зрения об оптимальных условиях проведения процесса модифицирования не существует, но во многих источниках литературы обсуждается влияние природы обменного катиона и температуры на стадиях получения на эффективность процесса и конечный результат.
Рисунок 14. Схема процесса пилларирования глины
Вариации условий процесса, а также природы и формы используемых реактивов позволяют достичь разнообразных конечных результатов.
На рисунке 15 по данным [105] показано схематическое изображение реакции обмена межслоевых катионов глины на поликатионы алюминия и превращение их в пиллары после прокаливания. Во время прокаливания при повышенных температурах полигидроксокатионы преобразуются в твердые оксидные столбцы, при этом высвобождаются протоны, которые мигрируют в силикатных слоях, становясь недоступными для ионного обмена. Это приводит к снижению ионообменной емкости пилларированных глин по сравнению с исходными.
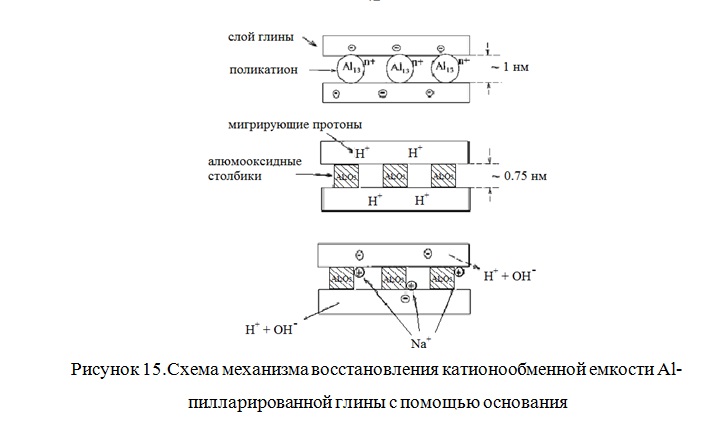
Статическая обменная емкость (СОЕ) пилларированной глины может быть частично восстановлена до значения СОЕ исходной глины путем обработки основаниями, например К2СО3, NaOH, KОН или раствором аммиака. Катионы металла располагаются в межслоевом пространстве глины, сохраняя баланс зарядов в пилларированной глине [105].
Существует 4 основных метода получения модифицирующих растворов:
- гидролиз Al3+ солей с NaOH,
- гидролиз Al3+ солей с Na2CO3,
- электролиз AlCl3,
- растворение металлического алюминия в HCl.
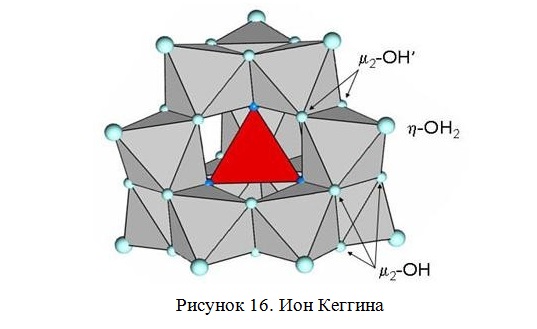
Наиболее часто в литературе встречается первый способ [106; 107]. При данном способе обработки интеркалирование глины проходит с участием полигидроксокатионов алюминия [Al13O4(OH)24+x(H2O)12-x](7-x)+ (для простоты Al13), так называемого иона Кеггина (Рисунок 16). Он представляет собой вытянутую сферу, состоящую из тетраэдра AlO4 в центре, окруженного двенадцатью октаэдрами гидроксида алюминия. Три октаэдра с общими гранями имеют свободные вершины, которые заняты кислородом, связывающим
гидроксильные группы или молекулы воды. Каждый октаэдр Al3+ иона находится на одинаковом расстоянии от соседнего.
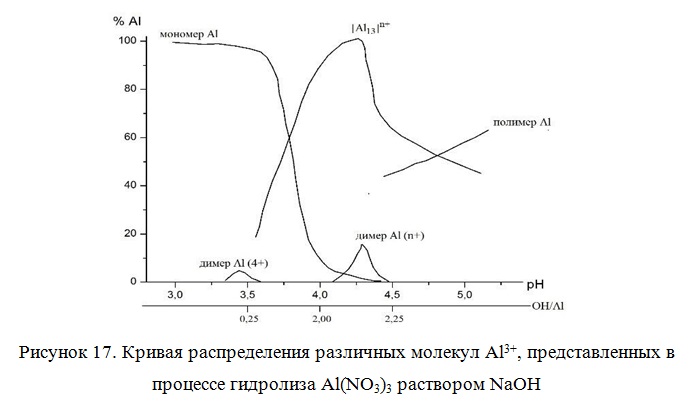
Образование полиядерных гидроксокомплексов алюминия в модифицирующем растворе является наиболее предпочтительным результатом гидролиза. Однако такая сложная система как [Al13O4(OH)24+x(H2O)12-x](7-x)+, способна существовать лишь в определённом интервале концентраций исходной соли алюминия, а также в сравнительно узком интервале рН. В зависимости от условий приготовления раствора, он может содержать: [Al(OH)x(H2O)6-x](3-x)+ мономеры; [Al2(OH)x(H2O)10-x](6-x)+ димеры, а также полимерные формы (Alpoly). При ОН/Аl<1 превалирует форма мономера, в то время как при 1,5<ОН—/Аl3+<2,3 Al13 становится основной формой в растворе. Дальнейшее увеличение степени гидролиза приводит к образованию полимера (Рисунок 17).
От природы гидроксокомплексов зависят текстурные характеристики получаемого материала . В изложенных ранее работах показано, что рациональным значением соотношения ОН—/Аl3+ при приготовлении модифицирующего раствора является величина порядка 2-2,4.
Во время следующей стадии – ионного обмена, ионы, содержащиеся в межслоевом пространстве, заменяются на гидроксокатионы алюминия. Далее глина подвергается сушке. Показано, что медленная сушка на воздухе способствует формированию параллельных слоев, тогда как сушка при помощи вымораживания ведет к беспорядочной ориентации слоев (Рисунок 18).
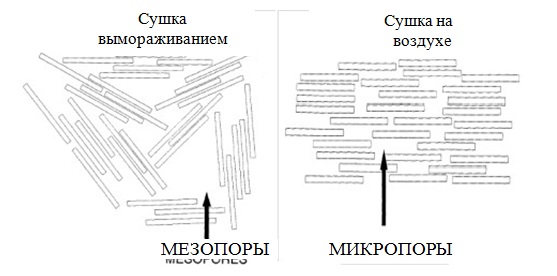
Рисунок 18. Различие между глиной, высушенной на воздухе и глиной, высушенной замораживанием
Заключительной стадией синтеза пилларированных глин является термообработка. При температуре 573-773К гидроксокатионы алюминия переходят в оксид алюминия, образуя прочные столбцы.
[Al13O4(OH)24(H2O)12]7+→6,5 Al2O3 + 20,5 H2O + 7 H+ (2)
Таким образом, получается регулярная микропористая структура, которая позволяет использовать пилларированные глины в качестве адсорбентов.
Предполагается, что адсорбционные свойства пилларированных глин сильно зависят от размеров и качества наноразмерных оксидных столбиков: высота столба влияет на объем пор, расстояние между слоями и на адсорбционную емкость; распределение и плотность столбов между слоями глины влияет на стабильность, а так же на объем пор; природа пилларирующих материалов оказывает влияние на адсорбционное поле в порах.
Ввод дополнительного элемента (Fe, Al, Ti, Zr, La) положительно влияет на адсорбционную емкость интеркалированных глин по компонентам воздуха, а в зависимости от типа столбцов меняются размеры пор и их объем (Таблица 11)
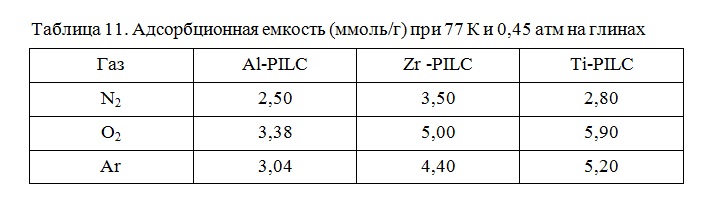
Расстояние между слоями образцов Ti-PILC глин, составляет 16-20 Å, а для Zr –PILC – только 4 Å. Заметно, что Ti-PILC и Zr-PILC проявляют более высокую адсорбционную активность по газам, чем Al-PILC. Элементный анализ и текстурные характеристики глин, содержащих катионы Fe3+ и смешанных железосодержащих пилларированных глин, представлены в таблице 12 [109].
Таблица 12. Текстурные характеристики и адсорбционная емкость по CO2 и N2 глин
обавление ионов хрома и циркония, по мнению авторов, вызывает появление дополнительных активных центров сорбции газов. Авторы объясняют этот факт различным состоянием металлов в глине: железо находится в связанной форме в виде оксидных столбиков, а хром присутствует в виде столбиков и катионов (Cr3+), что вносит дополнительный вклад в электрическое поле в микропорах. В результате модификации Al-пилларированной глины ионами Sr2+ авторы получили субстрат (Sr-Al-PILC) с высокой адсорбционной емкостью и селективностью по газам, обладающим квадрупольным моментом: N2, O2, CO2 (Таблица 13).
Таблица 13. Адсорбционная емкость (ммоль/г) образцов пилларированых глин при 0,45 атм и 273К.



ИННОВАЦИОННЫЕ ТЕХНОЛОГИИ И ПЕРЕДОВОЕ ОБОРУДОВАНИЕ ДЛЯ ПОТОКОВ В ПРОМЫШЛЕННОСТИ И НЕФТЕХИМИИ +7 499 9645605 info@eldeprocess.ru +7 925 9251421548